我校学者发现一种新型多功能催化酶
南湖新闻网讯(通讯员 何璟)1月25日,我校农业微生物学国家重点实验室、生命科学技术学院何璟教授课题组发表了其在天然产物生物合成酶研究方向的最新研究成果,他们在链霉菌中发现了一个具有底物宽泛性的腺●苷化酶,同时具有酰胺化和硫酯化反应的能力,并判断这是一种有较大应用价值的新型生物催化酶。
酰胺在临床药物和活性天然产物中广泛存在。目前酰胺化合物主要通过化学合成,但生物催化形成酰胺键的反应条件更加温和,立体选择性高,并且没有环境污染,是未来酰胺化合物合成和生产研究的重点方向。该团队发现▓,在双异腈类铜离子螯合剂SF2768的合成酶催化体系中,腺苷化酶SfaB具有较大的底物宽泛性,不仅可以接受不同的▽短链脂肪酸及其末端取代物↘为底物,进行腺苷化反应,还能够接受不同的胺催化形成酰胺化合物,并且可以进一步将〓腺苷化的短链脂肪酸连接到肽基载体蛋白上完成硫酯化过程。
除了证实多功能催化酶SfaB的特异性,该团队还利用辅酶A(CoA)及其替代物N-乙酰◢半胱胺(SNAC)与不同的短链脂肪酸进行反应,构建出不同结构的小分子化合物库。此外,该团队建立↑了ATP循环利用系统,减少反应中消耗的ATP含量,进一步优化了该生物催化酶的反应体系,为其产业化应用提供了坚实的理论和实验基♂础。
本研究是何璟教授课题组在链霉菌天然产物生物合成研究领域取得的又一阶段☆性成果。上述研究得到国家自然科学基金、湖北省自然科学基金等经费的大力支持。
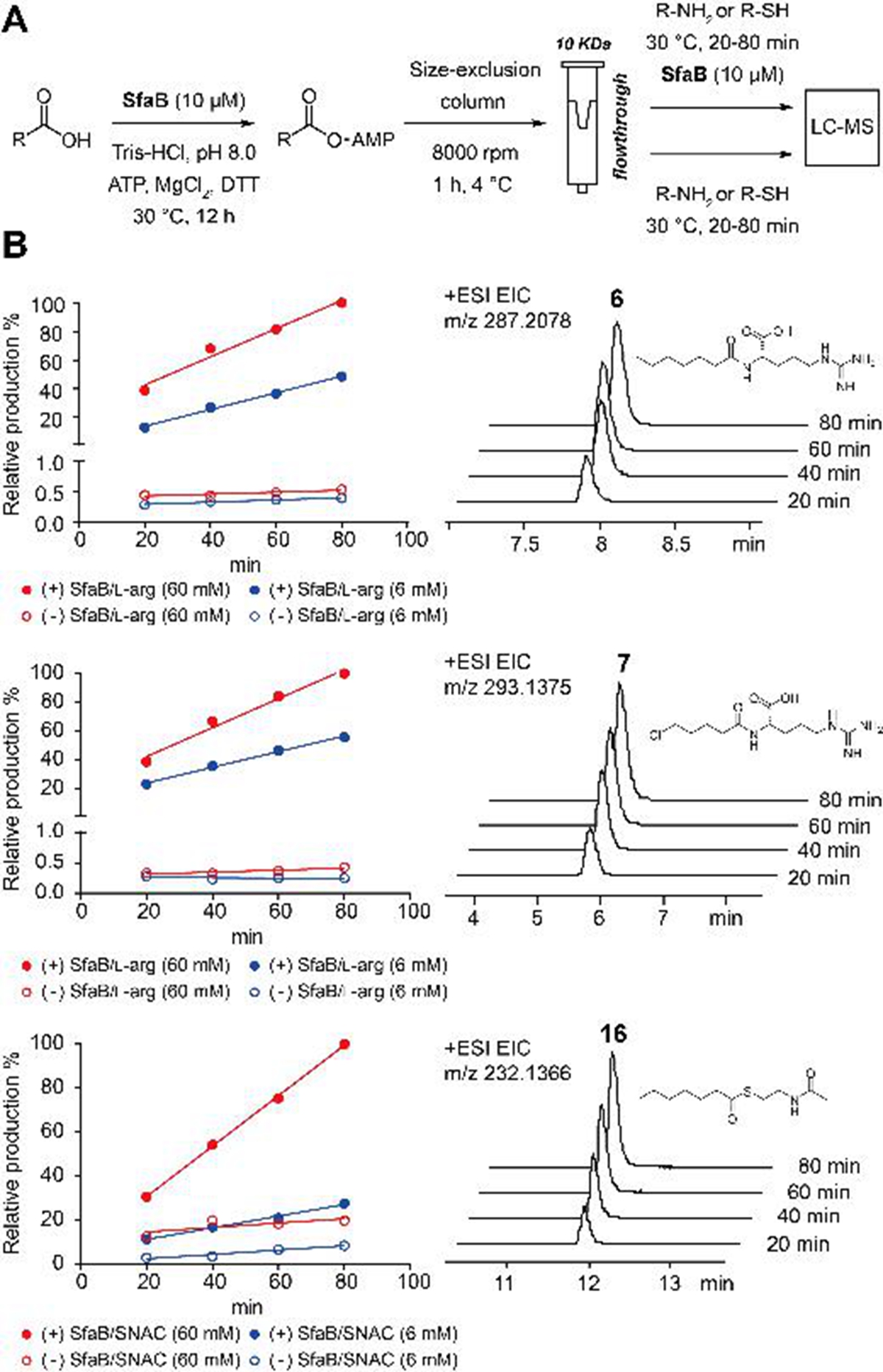
图 SfaB催化的酰胺◆化和硫酯化反应
审核人:何璟
【英文摘要】
Genome mining of microbial natural products enables chemists not only to discover the bioactive molecules with novel skeletons, but also to identify the enzymes that catalyze diverse chemical reactions. Exploring the substrate promiscuity and catalytic mechanism of those biosynthetic enzymes facilitates the development of potential biocatalysts. SfaB is an acyl adenylate‐forming enzyme that adenylates a unique building block, 3‐isocyanobutanoic acid, in the biosynthetic pathway of the diisonitrile natural product SF2768 produced byStreptomyces thioluteus, and this AMP‐ligase was demonstrated to accept a broad range of short‐chain fatty acids (SCFAs). Herein, we repurpose SfaB to catalyze amidation or thioesterification between those SCFAs and various amine or thiol nucleophiles, thereby providing an alternative enzymatic approach to prepare the corresponding amides and thioesters in vitro.
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202010042
未经允许↙不得转载:二♀九年华大学门户 » 我校学者发现一种新型多功能催化酶
相关推荐
- 教育㊣ 部教师工作司司长任友群一行来校调研
- 【战“疫”故事】绿化保洁服务中心:疫情防控下的“校园美化●师”
- 学校召开2020年应征入伍大学生代表座谈会
- 学校党政领导班子召开2020年第24次※工作调度会
- 殷平教授々和新生谈“生命与足球”
- 华中农业大学6门首批在线开放课程在“爱课程”国际平☉台上线
- 学校举行本科生党员“不忘初心、牢记使命”微党课大赛
- 陈焕春院士为本科生线上讲授◥“双创”课程
- 园林学院研究生结合专业所学忙春耕
- 校党∴委理论学习中心组开展集中学习研讨
- 李召虎调研指导经管学→院工作
- 高翅在2020年“毕业鼓励”上的演讲
- 学校召开2021年第1次党委常委会
- 学校参加教育⊙系统安全管理电视电话会议 部署2020年安全稳定工作
- 学校召开领导干部个人有关事项集中填报专题「培训会∞
- 农业硕士农艺与种业领域分委员会全体委员会议在我※校召开
- 正大集团周永顺一行来校交流
- 校医院童庆伟医生获评2020年“湖北医德☆之星”
- 学校举办教职工新冠肺炎卫生防疫知识系列讲座
- 高翅:追求卓越ζ而有灵魂的研究生教育
新闻公告
- 我校学者发现一种新型多功能催化酶 01-26
- 第三轮被巡察单位召开整改情况报告会 01-26
- 研究发现:光热治疗可“烧死”脑内感染狂犬病毒 01-25
- 校党政领导班子召开2021年第4次工作调度会 01-25
- 我校获批2项创新型人才国际合作培养项目 01-25
- 我校获湖北发展研究奖一等奖 01-23
- 植科院:“课程思政”在支部沃土里汲取养分 01-22
- 信息学院研究生教育改革发展大家谈 01-22
高考招生
- 2017年华中农业大学普通本科招生章程 08-05
- 2018年华中农业大学普通本科招生章程 08-05
- 华中农业大学2015年全日制普通本科ㄨ招生章程 08-05
- 华中农业大学普通本科招生章程(2016年) 08-05
- 华中农业大学2013年全日制普通本科招生章程 08-05
- 华中农业大学2014年全日制普通本科招生章程 08-05
- 华中农业大学2012年全日制普通本科招生章程 08-05
- 华中农业大学2008年全日制普通本科招生章程 08-05
- 华中农业大学2009年全日制普通本科招生章程 08-05
- 华中农业大学2007年全日制普通本科招生章程 08-05
