[成果]北师大王占新教』授及其合作团队首次揭示了NSD家族组蛋白赖氨酸甲基转移酶修饰核小体的分子机理
北京师范大学生命科学学院细胞生物学研究所王占新教授与国内外专家合作共同揭示了NSD家族蛋白催化核小体H3K36位点甲基化修饰的分子机理,该成果已于2020年12月24日在《Nature》上在线发表 (https://www.nature.com/articles/s41586-020-03069-8)。王占新教授和南方科技大学的冷冻电镜中心、美国斯隆凯特琳癌症研究所的Dinshaw Patel教授以及美∩国斯坦福大学的Or Gozani教授为该文的共同通讯作者,南方科技大学的李婉秋博士、北京师范大学的田伟和邓谱涓博士以及斯坦福大学的Gang Yuan(袁刚)博士为本文↘的共同第一作者。

人源NSD家族蛋☆白包括NSD1、NSD2和NSD3三个成员,都是组蛋白H3第36位赖氨酸的二甲基转移酶。NSD家族蛋白调控染色质结构,是重要的表观遗传调控因子◣,在高等动物细胞中发挥重要的生理功能,其成员的异常表达或者突变与人类多种癌症相关,比如NSD3与急性白血病和头颈癌等相关,NSD2与人类的多发性骨髓瘤以及Wolf-Hirschhorn综合征等疾病相关,目前还没有针对该家族蛋白的特∑效药。该工作解析了NSD3和NSD2与核小体复合物较高分辨率的冷冻电镜结构,发现NSD2和NSD3倾向于结合含有linker DNA的核小体。NSD2或NSD3解离核小体核心颗粒√出口或入口处缠绕的DNA,其催化结构域结合在核小体核心组蛋白与解离的DNA之间,通过与核小体DNA和组蛋白一系列位点特异的相互∑ 作用得到激活并发挥H3K36位点的甲基转●移酶活性。这些与核小体位点特异的相互作用使得NSD蛋白的催化结构域以较为伸展的构象结合在核小体上,使得含有H3K36位点的组ξ蛋白尾巴能够结合在催化位点并激活NSD蛋白。该工作进一步发现几个癌症相关的NSD2和NSD3突变,例如NSD2的E1099K和T1150A突变,以及这两个突变在NSD3中对应的E1181K和T1232A突变,都会分别增强NSD2或NSD3的催▅化活性,促进癌细胞的增殖并促进移植瘤在裸鼠ξ 体内的生长。结构分析表明NSD2的E1099K突变及其对应的NSD3的E1181K突变虽然远离组蛋白H3的催化位◥点,但是该突变会通过增强NSD蛋白与核小体DNA的相互作用来增强其催化活性。NSD3的T1232A突变靠近组蛋白H3K36的结合位点,该突变会增强组蛋▓白尾巴与催化结构域结合的稳定性以增强其催化活性。综上,该工作首次揭示了NSD家族蛋白以核小体为底物催化组蛋白甲基化的分子机制,以及其癌症相关》突变可能致病的分子机理,为进一步理解NSD家族蛋白的生理功能以及靶向NSD家族蛋白的药物研发提供重要分子基础。
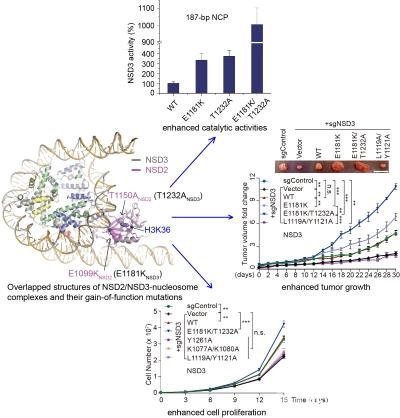
NSD2和NSD3结合←核小体的冷冻电镜结构。其中一些致癌突变会增加NSD3的催化活性,增加癌细胞的增殖,并增加裸鼠移植瘤的生长速率。
该工作得到了国家自然科学基金、北ζ京师范大学自主基金、南方科技大学和深圳市基金以及美国多项基金的资助。上海蛋白质设施的冷冻电镜中心和南方科技大学的冷冻电镜♂中心为该工作数据的收集提供了重要支持。生物物理所的李国红ζ 老师、北京大学的高宁老师和南方科技大学的龚欣老师为本工作提供了重要帮助。
未经允许不得转载:二九年华大学门户 » [成果]北师大王占新教授及其合作↓团队首次揭示了NSD家族组蛋白赖氨酸甲基转移酶修饰核小体的分子机理
相关推荐
- [观点]张琦:以更大决心、更强力度推进脱贫攻坚
- 北师大物理学系师生参加“不忘初心、牢记使命”专∏题报告活动
- 北京师范大学第二届传统文化推广月举办
- 中国教师教育精准帮扶大型公益活动 “启师?沃土计划” “三区三州”区县教师教育新体系建设 暨教师教育者教育能力㊣ 提升研修项目举行
- 北师大组织中层干部参观“伟大历程 辉煌成就——庆祝中华人民共和国成立▆70周年大型成就展”
- 周作宇参加国际处民主生活会和组织生活会
- 2020“时代青年说——砥砺奋进,做好乡村振兴大文章”专题论坛暨主题演讲比☆赛举行
- 北师大校友会召开第七届理事会第三次会议
- 北师大召开 “师说,我这三十年”满30年教龄〓教职工座谈会
- 白俄罗斯国立师范大学校长一行访问北京师范№大学
- 学校举办离退休教职工迎2021新年游艺会
- 北师大附校联盟“一带一路”艺体共卐享计划赴德国、捷克交流
- 北京师大附中荣获北京国际电影节青少年科学影像单元一等奖
- 北师大文学院梁振华教授作品《澳门人家》荣获中国电视金鹰奖优秀电视※剧提名
- 话剧《启功》在北京师范大学举行首场演出
- [预告]11.30 中国会↑计改革与发展2019学术论坛暨杨纪琬会计学术思想研讨会
- 北师大总务举办“我和我的祖国”主题演讲比赛
- 北师大举办卐第59期学生青年共产主义者培训班开班仪式暨首场报告
- 英国♀皇家化学会会士、英国爱丁堡皇家Ψ 学会会士约翰?欧文教授受聘为北师大名誉教授
- 北师大与余姚市人民◤政府合作办学签约仪式举行
新闻公告
- [会议]北师大地理科学学部举办2020年学术年会 12-28
- 学校召开120周年校庆专项工作组会议 12-28
- 北师大举办高校党委组织部长和党建工作联络员培训班 12-27
- 天文系党总支开展全面从严治党主题教¤育活动 12-25
- 图书馆第三党支部开展线上学习 12-25
- 教育学部二级党校举办党员培训专题讲座 12-25
高考招生
- 北京师范大学2018年本科招生章程 08-05
- 北京师范大学2017年招】生章程 08-05
- 北京师范大学2015年招生□章程々■ 08-05
- 北京师范大学2016年招生章程 08-05
- 北京师范大学2012年招生章程 08-05
- 北京师范大学2013年招生章程 08-05
- 北京师范大学2014年招生章程 08-05
- 北京师范大学2009年招生章程 08-05
- 北京师范大学2010年招生章程 08-05
- 北京师范大学2011年招生章程 08-05
