黄志伟教授团队在《自然》发文揭示人T细胞受体-共受体(TCR-CD3)复合物组装的分子机制
哈工大报讯(季萱/文 刘洋/图)8月28日,我校生命学院黄志伟教授团队在《自然》(Nature)上在线发表题为《人T细胞受体-共受体复合物组装的结构基础》(Structural basis of assembly of the human TCR-CD3 complex)的研究文章(Article)。该◥研究首次解析了人T细胞受体-共受体(TCR-CD3)复合物(包含全部8个亚基)的高分辨率冷冻电镜结构,通过『对结构分析,揭示了TCR和CD3亚基在膜外侧以及膜内识别、组装成功能复合物的分子机制,从而回答了免疫领域关于T细胞受体结构的基础科学问题∮,对解析T细胞活化的分子机制具有重要的科学意义,同时也为开发基于T细╳胞受体的免疫疗法提供关键结构基础。
在黄志伟教授研究成果发布会上,哈尔滨医科大学校长张≡学教授作为专家对该成果进行了解读并给予高度评价,认为这是世界首〓次揭示T细胞受体复合物的结构,是中国科学家在免疫学→基础研究上取得的一项重大原创性发现。
T细胞是脊椎动物适应性免疫系统的关键细胞,在病毒←感染、癌症以及自体免疫疾病中起着关键作用。T细胞免疫反应包括由TCR首先识别▲抗原呈递细胞(APC)上结合⊙了抗原肽的MHC复合物(pMHC),然后TCR通过其结合的共受体(CD3)将抗原信号传递到CD3的ζ亚基╱的胞内ITAM区域,进而启动T细胞内级联免疫信号通路杀死病原感染细胞或肿瘤细胞。
大多数成熟T细胞(约95%)的TCR由通过二硫键相连的〒α和β两条异二聚体肽链组成,TCRα/β的可变区(Vα和Vβ)负责识别抗原信号,TCRα/β与含有γ/ε、δ/ε’和ζ/ζ’六个亚基进行信号传递的共受体CD3组成TCR-CD3受体复合物,该复合物决定@ 着T细胞的发育、激活以及对病原的免疫反∏应。在过去20年中,人们对TCR胞外可变区如何识别各种抗原进行了很深入的研究,但作为细胞免疫基础科学问题之一的TCR-CD3复合物组装以及信号转导的结构基础仍然◆未知。
研究团队首先对不同人的细胞库进行目的TCR的筛选确定研究对象,通过化学交联办法纯化蛋白复合物样品,通过冷冻电镜解析↘了第一个来源于人的TCRα/β-CD3复合物的3.7 ?的高分辨率结构(图一)。该TCR-CD3复合物结构包含完整∏的胞外结构域(ECD)以及所有跨膜区域,结构显示其由1:1:1:1的TCRα/β:CD3γ/ε:CD3δ/ε’:CD3ζ/ζ’八聚体亚基组♂装形成,这与之前的生化研究结果一致。TCR-CD3复合物▲的胞外区域由TCRα/β的恒定区以及连接胞外和膜内的连接肽结合CD3的γ/ε和δ/ε’两个二聚体模块组装而成,TCR-CD3复合物胞外区域的组装在接近细胞膜的外侧形成类三次对称的结构,TCRβ亚基的恒定区位于该三次对称▃结构的中心位置。CD3膜内↓部分由ζ/ζ’亚基的两个跨膜螺旋和γ/ε以及δ/ε’亚基的跨膜螺旋结合形成桶状构象。TCR-CD3复合物膜内组装由TCRα/β的两个跨膜螺旋通过疏水和々电荷作用插入CD3筒状跨膜结构中形成(图二)。因此,TCR-CD3各亚基近膜侧的连接肽以及膜内区域的强相互作用对整个复合物↘的组装起着关键作用。研究团队将该复ξ 合物结构与结合有pMHC的TCRα/β胞外的区域结构比较发现,pMHC的结合并没有☉引起TCRα/β结构的明显变化。
文章审稿人对该项研究给予高度评价:“该研究工作代表了细胞适应性免疫的分子机理研究的一个重要里程碑。通过阐明第一◇个在膜上组装的T细胞受体和其CD3共受体的结构,极大地增加了我们对T细胞︼识别抗原反应的激活机制的理解。”
西湖大学校长、中国科⌒学院院士施一公教授也对该项研究给予高度评价,认为“T细胞受体复合物结构之谜一直是世界顶级科学家们梦想解决的细胞适应性免疫学的重要科学问题,哈工∩大黄志伟团队对该复合物结构的解析是理解细胞适应性免疫机制的重要里程碑”。
我校ξ 生命学院博士生董德、硕士生林建铨以及北京大学博士生郑吕钦为论文并列◢第一作者。黄志伟教授和北京大学高宁教授为论文共同通讯★作者。生命学院技术员张百灵、博士后朱玉威等参与该研究部分工作。本项目受到国家自然科学基金委、哈工大青年科学家工作∞室等基金资助。
原文链接:https://www.nature.com/articles/s41586-019-1537-0
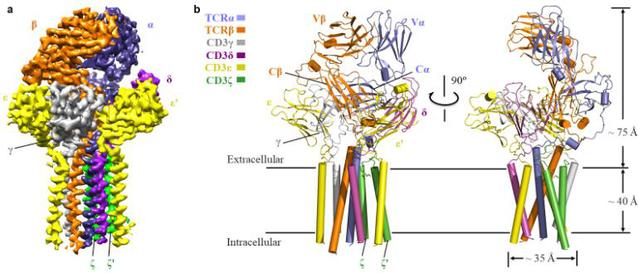
图一、TCR-CD3复合物的整体结构图
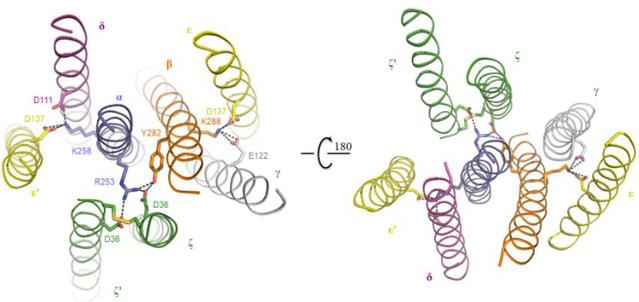
图二、TCR-CD3复合物细胞膜内组装的细节图

黄志伟教授团队

黄志伟教授☆介绍研究成果

黄志伟→教授接受采访
编辑:刘培香
未经允许不得转载:二九年华大学门户 » 黄志伟教授团队在《自然》发文揭示人T细胞受体-共受体(TCR-CD3)复合物组装的分子机制
相关推荐
- 校党委书记熊四皓与学生同上思↙政课、一起话初心
- 副校长徐殿国陪同省长王文涛赴俄【出席交流活动
- 第十一届深创赛哈尔滨高校预选√赛推进会召开
- 中建八局副总经理卢克强一行来校洽谈合作
- 闪亮“灯”场 我校第三届冰雪文「化节开幕
- 为建设美丽中国书写“哈工大答卷”——记“全国工人先锋→号”城市水资源与水环境国家重点实验室
- 中国华腾工业有限◣公司董事长赵晓龙一行来校调研
- 我校在中国高校创新』人才培养暨学科竞赛评估中位列全国高校前列
- “重大科学仪器设备开发”重点专项“分布式光纤应变监测仪”取得ω重要进展
- 顾敏院士受聘我校物理学院首席顾问
- 紧紧依♂靠师生员工坚决打赢疫情防控阻击战 学校应对疫情工作领导小组召开会议部ζ 署推进工作
- 行动起来 各显神通 我校所属企业和校友纷纷助力∞疫情防控
- 这个工程创新实践中心不一般:3D打印、AR、VR,还可制造各种机器人
- 东北联邦大学校长尼古拉耶夫一行来校访问交『流
- 深圳校区师生获2018年度中国人工智能学会大奖
- 我和我的哈工◆大 | 沈世钊院士的为人治学之道
- 西班牙塞维利亚大学客人来校访问
- 台湾铭传大学校长李铨一行来校访问并签署※合作协议
- 留学生保柳斯:在疫情中为中国点赞!
- 我校2019年第三次扶贫领导小组专题工作会议召开
新闻公告
- 学校召开2020年全面从严治党工作会议 04-15
- 在大师云端课中领略科学之美 04-15
- 曹萧瑶先生向哈工大教育发展基金会捐赠100万元 04-13
- 我和我的哈工大 | 刘家琦的“细流”人生 04-13
高考招生
- 哈尔滨工业大学2016年√本科招生章程 08-05
- 哈尔滨工业大学2017年本卐科招生章程 08-05
- 哈尔滨工业大学2018年本科招生章程 08-05
- 哈尔滨工业大学2014年本科招生章程 08-05
- 哈尔滨工业大学2015年本科招生章程 08-05
- 哈尔滨工业大学2012年本科招生章程 08-05
- 哈尔滨工业大学2013年本科招生章程 08-05
- 哈尔滨工业大学2011年本科招生章程 08-05
- 哈尔滨工业大学2009年本科生招生章程 08-05
